| Главная » Статьи » Мои статьи |
Тип урока: сообщение новых знаний и их совершенствование. Вид урока: лабораторная работа. Цель урока: получить в лабораторных условиях кислород и изучить его химические свойства. Задачи: образовательные:
развивающие:
воспитательные:
Оборудование. Опыт №1 Сухая пробирка с Н2О2, стакан, газоотводная трубка, спички, держатель, спиртовка, лучинка, штатив для пробирок. Опыт №2 Стакан, лучинка, спички, газоотводная трубка, известковая вода, катализатор МпО2, раствор Н2О2 Опыт №3 2 пробирки с пробками, чашка с водой, стакан с водой, газоотводная трубка, 2 металлические ложки, спички, спиртовка, штатив лабораторный, красный фосфор, сера (кристаллическая), колба с кислородом, пробирка с кислородом. Задача. Какая колба весит больше: с сухим или мокрым кислородом? (2 колбы с надписями “сухой кислород”, “мокрый кислород”) Ход урока 1. Оргмомент. 1. Формулировка темы урока, целеполагание. 2. Актуализация знаний (через химический диктант). 2. Проверка диктанта, самооценка. 4. Изучение нового материала:
6. Закрепление нового материала – через выделение главного – разгадывание шифровки. 7. Решение задачи. 8. Рефлексия. 9. Домашнее задание: параграф № 20, 19; приготовить сообщение о важнейших оксидах – воде, углекислом газе, железной руде, боксите – алюминиевой руде, песке - оксиде кремния, и др. упражнения 4-7 стр. 60. Содержание урока
Химический диктант 1. Это газ, имеющий запах (нет). 2. Он занимает 1 место во Вселенной по распространенности (нет). 3. При обычных условиях это газ без цвета, вкуса и запаха (да). 4. В лаборатории его можно получить из марганцовки (да). 5. Он легче воздуха (нет). 6. Он может быть твердым (да). 7. Его первым получил Ломоносов (нет). 8. В природе он в свободном состоянии не встречается, только в связанном (нет). 9. При температуре минус сто восемьдесят три градуса он превращается в жидкость (да). 10. В 1000 мл воды растворяется 30 мл этого газа (да). 11. Он получен Дж. Лавуазье из оксида ртути (да). 12. Его рейтинг на планете Земля самый высокий среди других элементов (да). 4. Проверка диктанта (на доске записаны правильные ответы) и самооценка Оценивание: 12 – 11правильных ответов “5”, 10 – 9 правильных ответов “4”, 8 – 7 правильных ответов “3”. Поднимите руки, кто получил “5”? Кто получил – “4”? Кто получил – “3”? Мы только начали изучать данную тему и у вас есть возможность поработать над своими ошибками и пробелами в знаниях. 5. Изучение нового материала. В тетрадях записываем лабораторная работа, тему и цель: получить, собрать, распознать газ кислород и изучить его взаимодействие с другими веществами. Фронтальная беседа. - Из каких веществ можно получить кислород? (Перечислить, написать уравнения) - Как можно собрать кислород? (Назвать два способа и обьяснить на каких свойствах кислорода они основаны) - Как распознать кислород? Выполняем опыт №1 “Получение кислорода из Н2О2”. В тетрадь записать:
В пробирке – кусочек Н2О2 (тв.) – закройте пробирку газоотводной трубкой, конец ее поместите в стакан, закрепите ее в держателе и нагревайте. Кислород тяжелее воздуха, он будет вытеснять воздух и займет объем стакана. Зажгите лучинку, потушите, тлеющею внесите в стакан с О2. Что мы наблюдаем? Где лучше горит лучинка? Почему? Какой вывод сделаем? (Лучинке лучше гореть в кислородной среде, чем в воздухе, т.к. в воздухе есть другие вещества.) Проведем опыт №2 “Получение О2 из Н2О2 в присутствии МпО2”. Снова будем получать О2 из Н2О2 – но не твердой, а раствора. МпО2 – это оксид марганца, порошок черного цвета. Прилейте к нему раствор Н2О2, закройте пробкой с газоотводной трубкой, конец ее поместите в стакан и наблюдайте. - Что происходит с раствором (в нем появляются пузырьки ). - Почему появились пузырьки? Какой газ при этом выделяется? (Кислород). Как доказать, что это кислород? (Тлеющей лучинкой). - Опустите в стакан тлеющую лучинку, что происходит? (Лучинка загорается). Дайте лучинке погореть и добавьте раствор Са(ОН)2 - известковой воды. Что наблюдаем? (Прозрачный раствор известковой воды мутнеет, т.к. при горении лучинки образуется углекислый газ, который взаимодействует с известковой водой, образуя нерастворимую соль карбонат кальция). Запишите в тетрадь: Опыт № 2 “Получение кислорода из Н2О2 в присутствии МпО2”
- Как вы считаете, какой способ получения О2 более простой? Более безопасный? Обоснуйте свою точку зрения. Запишите вывод. (В присутствии МпО2 – катализатора, реакция идет быстрее. Катализаторы – вещества, которые ускоряют химические реакции). А сейчас рассмотрим с какими веществами реагирует кислород. Опыт №3 “Химические свойства О2” Для проведения опытов я получу и соберу О2 из Н2О2 способом вытеснения воды. Пробирки с О2закрою пробкой. О2 – мало растворим в воде, поэтому его можно так собрать. - Вы уже провели реакцию взаимодействия О2 с углем (С), напишем уравнение. - Внесем Р - фосфор и S – серу в пробирки с О2, запишем уравнение реакции:
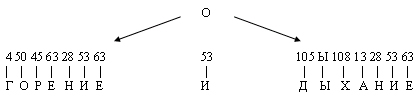
- Напишите уравнение, сверьте с учебником параграф 20. - Что можно сказать о химической активности О2 в сравнении с воздухом? - Какой сделаем вывод на основе наблюдений? - (О2 - активное вещество, реакции с его участием протекают более энергично, чем на воздухе). - Обратите внимание на вещества, которые получились. Что общего в составе? Из скольких элементов они состоят? Это оксиды – сложные вещества, состоящие из 2-х элементов, один из которых кислород. Реакции с участием О2 называется реакцией окисления (горения). О2 - окислитель! 6. Что же самое главное вы должны знать о кислороде? В каких важнейших процессах он участвует? Я зашифровала это с помощью цифр – ключ такой: цифра – это порядковый номер в таблице элементов, берите первую букву русского названия элемента.
7. Решение задачи. Демонстрирую учащимся 2 колбы, на одной из них надпись “сухой кислород”, а на другой “мокрый кислород”. Задаю вопрос: “ Какая колба весит больше с сухим или влажным кислородом?”. Ученики рассчитывают молярную массу кислорода и воды, сравнивают их и делают вывод, что сухой кислород тяжелее, чем мокрый. 8. Рефлексия. Стихотворение
Можно ли наш урок назвать исследованием, а вас исследователями? (Ответ аргументируйте). 9. Д/з. Параграф 20, 19 (уравнения учиться писать и расставлять в них коэффициенты) приготовить сообщение об одном из оксидов: SiO2, CaO, Al2O3, CO2, Fe2O3, H2O – проранжируйте их по степени значимости для человека и приготовьте презентацию или сообщение. | |
| Просмотров: 2186 | |
| Всего комментариев: 0 | |